文献信息
Wenqing Ma, Jiagang Hou, Siyu Liu, Tianzhen Jian*, Jianping Ma, Caixia Xu*, Hong Liu, Transforming Cu into Cu2O/RuAl intermetallic heterojunction for lowering the thermodynamic energy barrier of the CO2 reduction and evolution reactions in Li–CO2 battery, Journal of Energy Chemistry, 2024, 98, 531–540.
【原文链接】
https://www.sciencedirect.com/science/article/pii/S2095495624004893
成果简介
近期,济南大学马文庆-简天真-徐彩霞-刘宏教授团队通过驱动Ru−Cu−Al三元合金相与微结构重构,制备了多级多孔 Cu2O/RuAl异质结(MP- Cu2O/RuAl)。RuAl金属间化合物、富缺陷的 Cu2O,以及两者形成的纳米异质界面,赋予MP- Cu2O/RuAl独特电子结构;多级孔道和大表面积有利于传质、活性位点暴露、多相反应界面形成、放电产物均匀沉积;金属骨架可提高导电性和结构稳定性。密度泛函理论(DFT)计算表明, Cu2O/RuAl界面调节了对反应物和产物的吸附,降低了CO2ER中锂解离相关决速步能垒,提高了电池反应动力学和可逆性。微分电化学质谱(DEMS)结果表明,充电过程中CO2析出量与转移电子数之比接近理论值3/4,表明MP- Cu2O/RuAl可催化Li−CO2电池可逆反应。通过脱合金化策略实现过渡金属氧化物与多孔金属的复合,为过渡金属氧化物基催化剂搭建了低成本性能提升技术平台。
研究背景
Li−CO2电池能够同时实现二氧化碳的资源化利用和电化学能量转换,被视为极具潜力的下一代电池技术。然而,放电产物Li2CO3具有较高分解反应能垒和缓慢的动力学。虽然施加较高充电电压可驱动其分解,但也会不可避免地引发电解液寄生分解等副反应,电池表现出能量效率低、可逆性差等问题。高效正极催化剂的设计开发,成为推动Li−CO2电池发展的关键。
本文中,作者采用脱合金化方法驱动Ru−Cu−Al三元合金成分与结构演化,制备了多级多孔Cu2O/RuAl异质结(MP-Cu2O/RuAl)。通过耦合Cu2O/RuAl异质结构和多级多孔协同优势,MP-Cu2O/RuAl表现出优异的CO2还原和析出反应催化性能。理论计算和实验研究表明,MP-Cu2O/RuAl独特的电子结构可有效调节反应物与产物吸附,降低CO2析出过程锂解离相关决速步能垒,提高Li−CO2电池反应可逆性和动力学。

实验分析
实验分析一
作者采用真空熔炼喷铸工艺制得Ru−Cu−Al前驱体合金 (图1a)。随后,前驱体合金在氢氧化钠溶液中脱合金化,制得多级多孔Cu2O/RuAl异质结(MP-Cu2O/RuAl)。XRD衍射花样表明,MP-Cu2O/RuAl主要由Cu2O和RuAl两相构成 (图1b)。位于221.9、431.1、485.7和632.0 cm-1的拉曼峰可归为Cu2O(图1c)。氮气吸脱附测试表明,MP-Cu2O/RuAl的比表面积为~27.4 m2 g-1(基于BET方法)。
图2a−g中SEM、TEM和HAADF-STEM照片表明,MP-Cu2O/RuAl具有丰富孔道和互连韧带。一级孔及其韧带尺寸分别约为几百和几十纳米;一级孔韧带上形成了尺寸为几十纳米的二级孔(绿色箭头指示)和几纳米的三级孔(红色虚线标示)。图2e−e4元素分布图显示,Ru、Al、Cu和O在MP-Cu2O/RuAl中均匀分布。HRTEM、SAED、FFT和IFFT证实,MP-Cu2O/RuAl具有丰富的Cu2O/RuAl异质界面(图2h,图3,图S5−S7)。
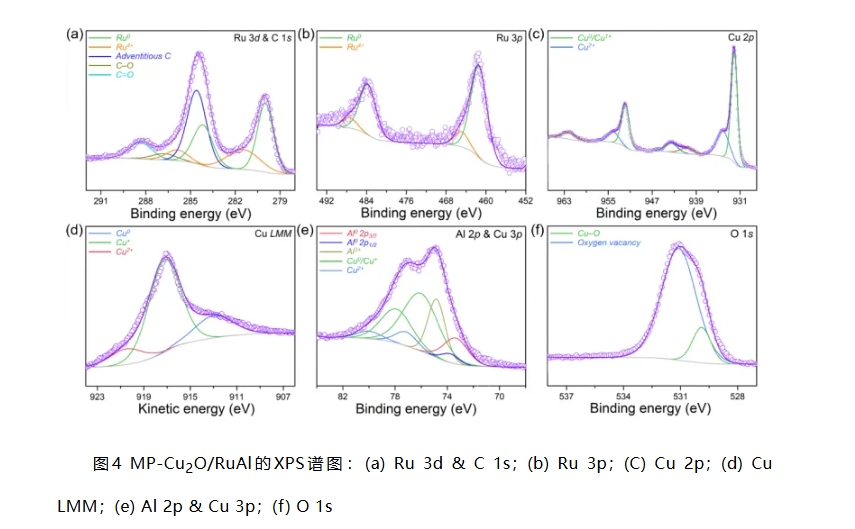
XPS测试表明,MP-Cu2O/RuAl中的Ru元素主要以金属态Ru0存在,且其结合能向低结合能明显偏移(图4a&b)。图4c中位于932.1和951.9 eV处的两个尖峰可归为Cu0/Cu1+,其相较于NP-Cu2O/Cu向低能级发生明显偏移。Cu LMM谱显示,俄歇电子跃迁动能为917.2 eV,表明MP-Cu2O/RuAl中Cu主要为Cu1+(图4d)。Al 2p谱中Al0的结合能向高能级偏移(图4e)。上述结果表明,MP-Cu2O/RuAl中的Al向Ru和Cu供给电子,从而赋予后两者较高电负性和催化活性。O 1s谱可分解为位于529.9和531.1 eV的两个亚峰,两者可分别归为Cu−O键和氧空位(图4f)。氧空位的形成有利于获得较高的电导率和催化活性。

实验分析二
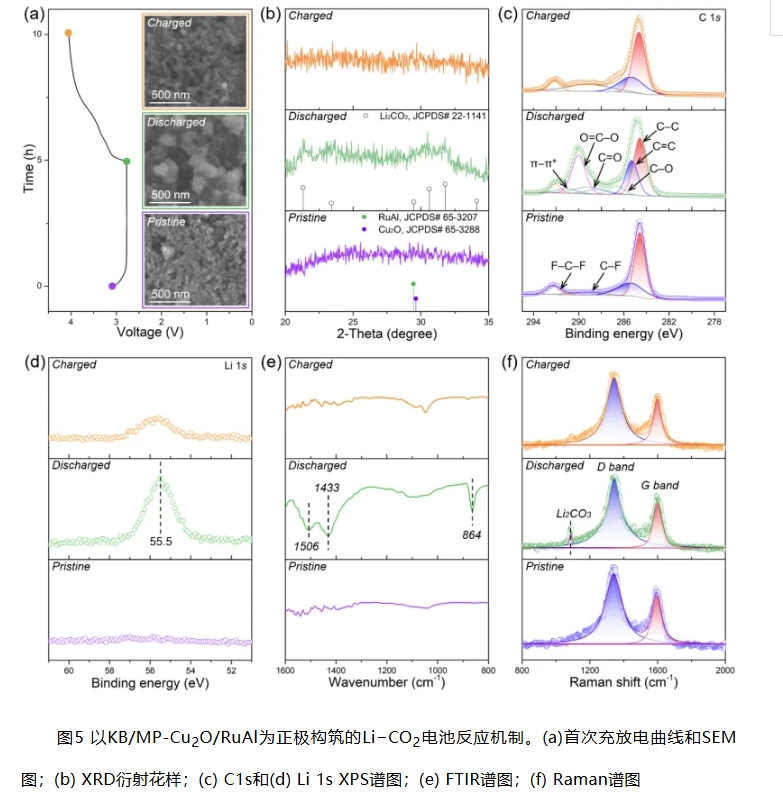
图5a中SEM照片显示,放电时电极表面出现不规则球形颗粒状放电产物,且放电产物在充电过程中几乎消失。XRD证实Li2CO3在放电时的生成及其充电时的有效分解(图5b)。放电态电极片的C 1s和Li 1s XPS谱图,分别在290.0 eV (O−C=O)和55.5 eV处显示出明显的峰,且这些信号在随后的充电中明显减弱(图5c&d)。FTIR和Raman结果与上述研究结果一致,进一步证实电池循环过程中Li2CO3的可逆形成和分解(图5e&f)。上述结果表明,MP-Cu2O/RuAl能够有效地催化可逆CO2还原与析出反应。
作者对比研究了MP-Cu2O/RuAl和NP-Cu2O/Cu的电化学性能。KB/MP-Cu2O/RuAl电池在200、500和1000 mA g-1时的充放电极化分别为~1.38、~1.50和~1.59 V(图5a&d)。虽然KB/NP-Cu2O/Cu在200 mA g-1表现出明显较低的充放电极化,但当提高电流密度时,极化显著增大(图5b&d)。当电流密度提高至1000 mA g-1时,KB/NP-Cu2O/Cu电池触发电压截止。倍率测试后,将电流密度调整为500 mA g-1,KB/NP-Cu2O/Cu电池无法达到截止容量,而KB/MP-Cu2O/RuAl电池在随后的140个充放电循环中表现出~1.50 V的稳定充放电终止电压差(图5c&d)。随后,KB/MP-Cu2O/RuAl电池的充放电极化逐渐增大,并最终在第202次充放电过程中触发电压截止,这应源于充放电过程中正极催化剂表面放电产物/副产物的逐渐堆积和负极金属锂的腐蚀(图S19&S20)。
实验分析三
Cu2O(100)/RuAl(011)异质结和Cu2O(100)均表现出适度Li吸附,表明它们均可在CO2还原反应中获取Li (图7a)。得益于RuAl金属间化合物和异质界面的构筑,Cu2O(100)/RuAl(011)表现出显著优于Cu2O(100)的CO2吸附能,有利于CO2的捕获与活化,从而提升CO2电化学还原反应动力学。此外,Cu2O(100)/RuAl(011)对Li2CO3和C都具有较高的吸附能,可有效地引导放电产物均匀沉积 (图7b)。Li2CO3中Li−O键具有较高结合能,与Li+解离相关的中间步骤也因此被认为是CO2ER的决速步。Cu2O(100)与RuAl(011)复合形成丰富的异质界面,增加了活性位点密度;驱动电子在Cu2O(100)/RuAl(011)异质结中的再分布,提升了催化位点活性,获得了较高Li2CO3与C可逆共分解反应催化活性。
图8采用DEMS采集的KB/MP-Cu2O/RuAl电池气体 (a) 消耗和 (d) 析出曲线。(b, c) 和 (e, f) 分别由 (a) 和 (d) 计算得出
原位DEMS显示,CO2实测消耗量(CM)最初几段(每5分钟为一段)的增量(∆CM)均高于理论值(∆CT = 0.816 μmol),这应源于KB/MP-Cu2O/RuAl对CO2的吸附 (图8a−c)。在随后的50 min内,∆CM −∆CT逐渐下降至~0 μmol,并略有波动,这一结果表明,CO2气体已经建立了吸附−消耗−解吸动态平衡。整个放电过程的CM为~10.59 μmol,比理论消耗量(CT = 9.79 μmol)高出~0.80 μmol,可归因于KB/MP-Cu2O/RuAl电极的吸附。电池充电时,PM在最初35 min内的各段增量值(∆PM)均明显低于理论值(∆PT = 0.816 μmol),但在随后的25 min内均高于∆PT。电池充电过程(前60min)的PM为~7.63 μmol,明显低于理论值(PT = 9.79 μmol)。值得注意的是,充电终止后,仍可检测到CO2析出信号(持续约25min)。充电过程中CO2析出总量为PM= ~9.36 μmol,其与转移电子数之比为~0.717,接近理论值3CO2/4e-。上述结果表明,MP-Cu2O/RuAl可有效催化Li−CO2电池可逆反应。









